今回は水素エネルギーについて取り上げます。前々回のエネファームの検討において、化石燃料を原料に生成した水素を使用して燃料電池で発電し、同時に排熱を利用することで効率的なエネルギー消費が実現できることを説明しました。
そして、都市ガスのように水素が家庭に直接供給されればエネファームの改質器(都市ガスから水素への改質)が不要となるため低コスト化し、省エネと低炭素化に優れたエネファームの有利性が向上することが期待されました。
水素エネルギーは脱炭素社会ではキーとなるエネルギーと言われており、それは以下の理由によります。
・再エネを用いて水電解法で製造できる脱炭素型のエネルギーである
・燃料電池を用いて電気に変換できる
・CO2と反応させて合成メタンや合成液体燃料に変換できる
・高温での熱利用には適さない電気に代わって、高温の熱利用に使用できる
このように有用な水素ですが、私たちの家庭生活で水素が一般的に使用される時が来るのかと疑問に思う人もいると思います。これまで使用してきた電気、都市ガス、ガソリンなどと比べて、水素はエネルギーとしてあまりにもなじみが薄いからです。その懸念は以下の通りです。
・水素というと何か危険な感じがする(安全性)
・これまで使われてきた既存のエネルギーに代わるには、多大の投資が必要(経済性)
・その投資に対して人口減少社会で負担が可能なのか(コスト負担)
・2次エネルギーとしての水素の製造効率(総合エネルギー効率)
そのような懸念や疑問に答えていくことが脱炭素社会への移行には必要です。社会的な大きな変革に対して人々が抱く意識上の障壁を取り除くことが、迅速な移行につながります。水素エネルギーについて、日本では一般の人々にはそれに関する情報がほとんど伝えられていないことが問題です。
-s.jpg)

本サイトではそのような背景から、水素エネルギーに関する基礎的な情報の提供を行うと同時に、今後日本が経済成長を伴う脱炭素社会への移行を行うために、水素エネルギーの利用においてどのような戦略をとっていくべきかについて考察していくこととします。
今回の報告はまず「脱炭素化になぜ水素が必要か」について解説します。さらに、水素に関する基礎的な情報、具体的には水素の製造や利用方法、他のエネルギーへの改質の可能性、輸送と貯蔵の方法を整理し、エネルギー供給における水素の可能性や課題について整理していきます。
| <本報告のコンテンツ> ■脱炭素社会になぜ水素が必要か (1)水素エネルギーとは (2)水素のエネルギーとしての利用 (3)水素のエネルギーとしての特徴 (4)脱炭素社会での水素の重要性 ■水素の製造方法 (1)副生水素 (2)化石燃料改質 (3)水電解 (4)バイオマスの熱分解 (5)水の熱分解 (6)光触媒による水分解 ■水素の利用方法 (1)燃料電池 (2)燃料電池自動車 (3)水素発電 (4)水素還元製鉄 ■水素の改質による他のエネルギー生成 (1)合成メタン(メタネーション) (2)合成液体燃料 (3)アンモニア ■水素の輸送、貯蔵方法 (1)水素の減容方法 (2)水素の輸送 (3)水素の貯蔵 ■水素利用の課題 ■付録 化学反応式における熱収支の計算 |
<スポンサーサイト>
脱炭素社会になぜ水素が必要か
(1)水素エネルギーとは
物質としての水素の特徴は、原子記号はH(Hydrogenの略)、原子番号が1番で、電子と陽子が1個ずつあり、最も軽い物質であると学校で習ったことを思い出すでしょう。そして製造方法は水を電気分解することで得られるということも知っています。
水素は自然界で最も多く存在します。宇宙の創生の時に最初に誕生したものが水素であり、水素からヘリウムが生じ、その後多くの物質が誕生したと言われています。そのため宇宙では水素が最も多くを占める元素です。地球上では水素は大気中にはほとんど存在しませんが、水として存在しています1)。
地球上の生物は炭素と水素が主成分の炭化水素でできており、使われている燃料の多くも炭化水素です。人類は化石燃料を燃焼させることで得られる熱(熱量)を生活や産業活動に利用してきました。しかし、燃焼により生じたCO2が地球温暖化の原因となるため、その排出量を削減することが求められています。
水素の燃焼熱も利用することができます。水素を燃焼させても水が発生するだけなので、環境に及ぼす影響がないクリーンなエネルギーです。化石燃料がCO2だけでなく、窒素酸化物や硫黄酸化物などの有害物質を排出するのとは大きく異なっています。
化石燃料が採掘するだけで得られる1次エネルギーであるのに対して、水素は他のエネルギーを用いて製造しなければなりません。これを2次エネルギーといいます。電力も2次エネルギーです。そのため、1次エネルギーに比べてコストが高いということがデメリットです。
これまでさまざまな水素の製造技術が開発されてきましたが、製造に使われる1次エネルギーによるCO2の排出を避けられないのが課題でした。化石燃料を原料として水素を生成する方法はもとより、電気分解のための電力に化石燃料を使っていれば、CO2の排出を防止できないのです。
水素は生成する際のCO2排出特性によって図-1のように分類されています2)。化石燃料を用いた電力により生成した水素は「グレー水素」と呼びます。また、化石燃料を用いた電力により生成し、排出されるCO2を回収、貯蔵する場合の水素は「ブルー水素」です。
そして、電気分解の電力に再エネを用いてCO2を排出しない水素を「グリーン水素」と言います。電力の脱炭素化の進行によって、水素の脱炭素化も進んでいくことになります。しかし、コストをどのように低減させるかが人類に与えられた大きな課題です。
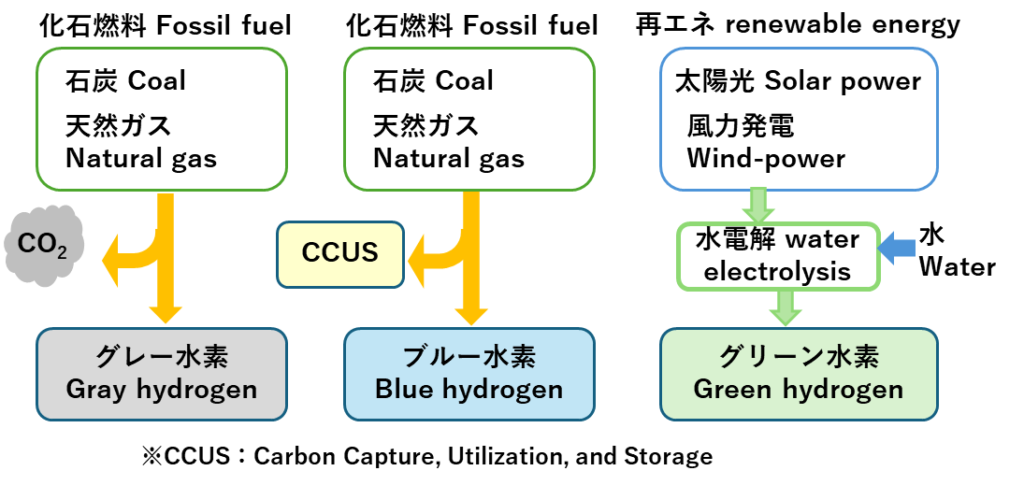
図-1 電力による水電解で生成した水素の種類
(2)水素のエネルギーとしての利用
水素エネルギーがこれまで全く使われていなかったかというとそうではありません。前回報告したエネファーム(家庭用燃料電池)やFCV(燃料電池自動車)などがその代表です。日本の一般世帯でも実際に水素が燃料として使われているのです。
かつて石炭が主要燃料として使われていた時代に石炭を乾留ガス化して都市ガスとして使っていた時代がありました。この石炭ガスの主成分は水素が5割を占め、メタンや一酸化炭素で構成されます3)。産業革命当時、ロンドンのガス灯は石炭ガスが使われていたようです。
日本では横浜のガス灯に使われたことを始めとして、都市ガスとして1950~1960年頃に一般家庭でも使われていました3)。その後、天然ガスなどを成分とする都市ガスに変わっていきました。燃料が石炭を中心とした時代の一時的なエネルギー利用とされています。
しかし、この原理は水素を生成する技術として現在も使われています4)。ガス化により発生するのは水素だけでなくCO、窒素化合物(NH3など)、硫黄化合物(H2Sなど)などの不純物が含まれるため、それらを除去するガス精製設備が必要です。また、原料が石炭という化石燃料であるため、排出した二酸化炭素を分離、回収する設備が必要となります。
次に、都市ガスや灯油を利用したエネファームは、化石燃料から水素を生成し、それを燃料電池により発電し、その電気と余熱を利用するものです。同様の原理で発電して走行する燃料電池車(FCV)も既に実用化されています。FCV用の水素は水素ステーションから供給することを想定しています。
水素を加工して生成されるアンモニア、合成メタン、合成液体燃料なども燃料として使用されます。多くの国では水素社会の構築にこれらの水素系の燃料も対象に戦略が立てられています。水素の輸送や貯蔵には課題があり、これらを水素キャリアとして利用するためです。
<スポンサーサイト>
(3)水素のエネルギーとしての特徴
水素の特徴を列挙すると以下の通りです1)。
・宇宙で最も豊富にある元素。質量では宇宙全体の約70%を占める
・水素単体では自然界にほとんど存在せず、地球上では化合物として存在する
・無色、無味、無臭の気体
・最も軽い気体(空気に対する比重0.0695)で、拡散速度が速い
・燃えても火炎がみえにくい
・燃焼すると酸素と反応して水になる
・-252.6℃で液化する
また、水素のエネルギーとしての特徴を表-1に示します。水素はガソリン、天然ガスと同様に可燃性ガスであり、高圧下においては金属材料を脆化するという特徴があります。一方で空気中での拡散が速く、着火温度が高いことから自然発火しづらい、熱放射による被害や類焼が少ないという特徴もあります。
表-1 水素のエネルギーとしての特徴
| 水素 | メタン | プロパン | ガソリン | 水素の特性 | |
|---|---|---|---|---|---|
| 拡散係数(空気中)cm2/s) (1atm、20℃) | 0.61 | 0.16 | 0.12 | 0.05 (ガス状) | 拡散しやすい。 小孔から透過しやすい。 |
| 金属材料を脆化 | あり | なし | なし | なし | 金属をもろく、割れやすくする。 |
| 最小着火エネルギー(mJ) | 0.02 | 0.29 | 0.26 | 0.24 | 着火しやすい。 |
| 燃焼範囲(下限~上限)(vol%) | 4.1~75 | 5.3~15 | 2.1~10 | 1.0~7.8 | 燃焼可能濃度範囲が広い。 |
| 熱放射(輻射率ε) | 0.04 〜0.25 | 0.15 〜0.35 | ガソリン並 | 0.3 〜0.4 | 熱放射による被害や類焼は少ない。 |
| 最大燃焼速度(cm/s) | 346 | 43.0 | 47.2 | 42.0 | 爆風圧が大きい。 ジェット火炎が保炎しやすい。 |
| 燃焼熱(MJ/Nm3) 真発熱量 | 10.8 | 35.9 | 93.6 | ─ | 熱量を確保するのに高圧を要す。 |
水素もガソリンや天然ガスと同様に、その性質、特徴を踏まえ、安全に使いこなす技術と社会制度を確立することが必要です。表-1にある水素の燃焼熱を見ると10.8MJ/Nm3でありメタンなどと比べると低い値となっていることが分かります。
水素の燃焼における熱化学反応式はコラムに示す通りです。水素の燃焼における発熱量は286kJ/mol(12.8kJ/L)です。これは総発熱量(高位発熱量)であり、真発熱量(低位発熱量)にするために水の凝縮熱(44kJ/mol≒2kJ/L)を減じると10.8kJ/Lとなって表-1の値と一致します。
| <水素の燃焼反応> H2(g)+1/2・O2(g)→H2O(l) ΔH = −286 kJ/mol ※反応式中の(g)は気体、(l)は液体を意味します。 ※ΔHは反応前後のエンタルピーの差を指します(左辺-右辺) ΔHが正の場合は吸熱反応、負の場合は発熱反応です。 ※生成物が液体の水の場合は、ΔHは総発熱量(高位発熱量)です。 ΔHの計算法については、本報告の末尾の付録を参照ください。 ※気体1molの体積は22.4Lであるため、容量当りでは12.8kJ/Lです。 |
本報告では化学反応の熱収支に着目しています。これは、物質の燃焼による発熱量を把握するとともに、水素を含む物質の生成に必要なエネルギーに関する情報も得るためです。熱収支の計算法は付録に記載していますので参考にしてください。
(4)脱炭素社会での水素の重要性
脱炭素社会での水素を利用する意義を総括すると以下の3点です1)。
(a) エネルギー・セキュリティの向上
(b) 省エネルギー、環境負荷低減
(c) 産業振興
まず、エネルギー・セキュリテイとはエネルギー安全保障とエネルギーの安定供給の2つの意味があります。
エネルギーの安全保障とは、水素は再エネを使って水電解によって製造でき、それを燃料などに利用することができるため、化石燃料のように輸入などに頼らずエネルギーを確保できることです。中東の石油危機やウクライナ戦争などによる天然ガスの調達などの問題を解消できるとされています。
一方、エネルギーの安定供給については、水素は貯蔵ができない電力を一時的に貯蔵することが可能なことです。再エネのように変動する電力を一時的に水素にして貯蔵し、電力の不足する時間帯に水素を用いて発電することで安定的な電力の供給を実現します。これは、揚水発電や蓄電池と同じ機能です。
次に省エネ、環境保全についても、いくつかの要素を含んでいます。まず、省エネとしては、燃料電池に見られるように、電力と排熱の利用(コジェネレーション)を総合的にみるとエネルギー利用効率が極めて高いことが挙げられ、省エネになるということです。
また、環境保全としては化石燃料が燃焼時に窒素酸化物(NOx)や硫黄酸化物(SOx)などの有害物質を排出するのに対して、水素は燃焼しても水を生成するだけであり、環境への影響を及ぼすことはありません。
そして、化石燃料に対する水素の最も大きな特徴は燃焼してもCO2を排出しないクリーンエネルギーであることです。そして、水素はメタネーションなどにより他のエネルギー密度の高い燃料に改質することができ、都市ガスや自動車燃料などにも使用ができます。
水素を再エネを使用して生成し、工場等で排出されたCO2を使って他の燃料に改質することで、エネルギー使用における脱炭素を実現できます。このように水素はカーボンリサイクルの原料として必要不可欠な物質であり、脱炭素社会において最も重要な物質といえます。
さらに、高温の熱需要を伴う産業分野では、電化のみでは製造プロセスの完全な脱炭素化は困難です。例えば、製鉄プロセスの場合、水素を還元剤や燃料として活用することで、CO2の排出を抜本的に抑えることが可能となります5)。
さらに、産業振興としては水素・燃料電池関連の市場規模は、我が国だけでも2030年に1兆円程度、2050 年に8兆円程度とされています。世界的にも水素関連産業を国の経済成長の柱にするという動きの中で、日本にとって技術的に競争力のある(特許件数最大など)産業分野で市場を支配していくとされています。
<スポンサーサイト>
水素の製造方法
水素の製造方法には表-2に示す方法があり、同表にその特徴を示します1)。副生水素、化石燃料改質、水電解、バイオマスは既に実用化されており、熱分解と光触媒は研究開発段階にあります。引用文献が2013年の資料であるため実用化の段階の記述には注意が必要です。さらに、再エネのコストのように水素の製造コストについては現在大きく改善されている可能性があります。
表-2 水素の製造方法の特徴
| 製造方法 | 実用化段階 | 安定性 | 環境性(CO2排出) | 経済性 |
|---|---|---|---|---|
| 副生水素 | 種類によるが既に導入されているもの多い。 | 本来の目的となる製品の生産量に左右される。 | CO2は排出されるが追加的な環境負荷は無い。 | 福次的に生産されるものを活用するため経済的。 |
| 化石燃料改質 | 既に導入されており実用化段階。 | 安定的かつ大規模に生産が可能。 | CCS等を用いない限り、CO2が排出される。 | 技術的に確立しており、比較的安価に製造が可能。 |
| 水電解 (火力) | 既に導入されており実用化段階。 | 安定的かつ大規模に生産が可能。 | CCS等を用いない限り、発電時にCO2が排出される。 | 改質に比べると高コストだが比較的安価。 |
| 水電解 (再エネ) | 技術的には確立。再エネ発電の低コスト化が課題。 | 再エネの種類によっては出力変動が存在。 | CO2は排出されない。 | 再エネ電力を活用するため一般的に高い。 |
| バイオマス | 技術的には確立しているが低コスト化が課題。 | 供給地が分散している。 | CO2排出量はゼロとみなすことができる。 | 現段階ではコストは高い。 |
| 熱分解 | 研究開発段階(一部実証も実施)。 | 安定的な供給が可能。 | 利用する熱を何から取るかによって異なる。 | N.A |
| 光触媒 | 基礎研究段階(現在の変換効率は 0.5%程度)。 | 気象条件に左右される。 | CO2は排出されない。 | N.A |
(1)副生水素
副生水素は、多様な工業プロセスから副産物として生産される水素のことで、主にソーダ産業から副生される水素と製鉄所からの副生水素があります。ソーダ電解からの副生水素は純度が高いですが、製鉄所からの副生水素は純度が低いため濃縮する必要があります。
ソーダ電解自体はCO2を発生しないものの、製鉄所での水素製造プロセスではCO2を発生させるため、大規模プラントの利点を生かした炭素隔離の検討も必要になります。
(2)化石燃料改質
化石燃料を改質して製造される改質法は、水蒸気改質法、部分酸化改質法、その両方をミックスしたオートサーマル改質法があります。現在主流なのは水蒸気改質法であり、特に天然ガス(メタン)を原料に用いるものを水蒸気メタン改質(SMR:Steam Methane Reforming)と呼びます。
技術上の課題は少ないですが、CCS(CO2回収・貯留)等をしない限り化石燃料由来のCO2 が発生するので、その隔離のためにコストを要し、その低減が課題です。
(3)水電解
水電解とは水の電気分解のことであり、実用技術としてはアルカリ水電解法と固体高分子形(PEM 形)水電解法があります。
アルカリ水電解法は、水酸化カリウムの強アルカリ溶液を用いて水電解を行うもので、大規模水素製造用として工業分野で実績があります。固体高分子形水電解法は1970年代初期にGE が燃料電池の技術を適用したもので、日本では1975年頃に膜・電極接合技術が研究され、実用化されてきました。
固体高分子形水電解は電流密度を高くできるため電解槽を小型化できますが高価な材料を使用します。水素製造におけるコスト(設備費含む)に関しては、固体高分子形水電解はアルカリ水電解の2~3 倍ですが、今後のコスト低減が期待されています。
一般に水電解は、温度が高いほうが理論電解電圧は低くなるので高効率となります。そのため高温水蒸気を水電解する技術として水蒸気水電解(800~1000℃レベル)が研究され、固体酸化物形燃料電池(SOFC)の排熱を有効活用する方法が実用化されています。
使用する電力は脱炭素電源が理想的であり、ドイツを中心とした欧州では再エネ(特に風力発電)からの余剰電力を水素やメタンに変換して活用するPower-to-Gasプロジェクトが実施されています。
(4)バイオマスの熱分解
バイオマス熱分解とは、バイオマス(木材など)を乾留(無酸素化下で熱分解)させ、水素や一酸化炭素などの乾留ガスを得て、水素を分離精製するものです。バイオマス熱分解による水素製造で主に使用されるのは、木質類や間伐材・廃木材・建設廃材です。
また、本技術による水素コストはバイオマスコストに依存するため、収集コストを含めたコスト低減が必要です。
(5)水の熱分解
水は2,000℃以上で水素と酸素に分解しますが、そのような高温を確保することは難しいうえ、その温度に耐えられる材料も限られます。そのため多様な反応を組み合わせ、間接的に水を熱分解する方法が考えだされています。
欧米では太陽光集光装置(ヘリオスタット)を活用することが検討されています。EUで太陽熱を用いた水分解による水素製造プロジェクトが実施されました。2008年に100kWの実験施設で水素発生を成功させ、2010~2012年には後継プロジェクトHydrosol 3Dが行われています。
また、日本では太陽光集光システムとフェライト系の水熱分解プロセスを用いて、水素を製造する実証を行っています。内閣府の戦略的イノベーション創造プログラム(SIP)のエネルギーキャリア研究開発では、従来約900℃で行っていた水素製造を、より低温(650℃)で行えるプロセスの開発が進められており、熱源として太陽熱の利用が想定されています。
(6)光触媒による水分解(人工光合成)
光触媒による水分解とは、光触媒を利用して光によって水を直接分解する方法です。これは光触媒の表面に太陽光があたることで電子が価電子帯から伝導帯へと励起され、励起された電子が水を還元し水素を発生させ、価電子帯に生じたホールが水を酸化して酸素を発生させるものです。
現状で基礎研究開発レベルです。特に紫外光域で高活性を示す光触媒は多いが、可視光域で高活性を示す光触媒はまだ少なく、さらなる材料探索が必要とされます。
<スポンサーサイト>
水素の利用方法
水素の利用方法としては図-2に示すように工業プロセスでの利用、燃料や発電原料、燃料電池などがあります。それぞれの利用方法で現在実用化されているものと開発段階のものがあります。現在開発中のものとして水素還元製鉄や水素発電などがあります。以下に広く利用されている燃料電池と現在開発中の技術について解説します。
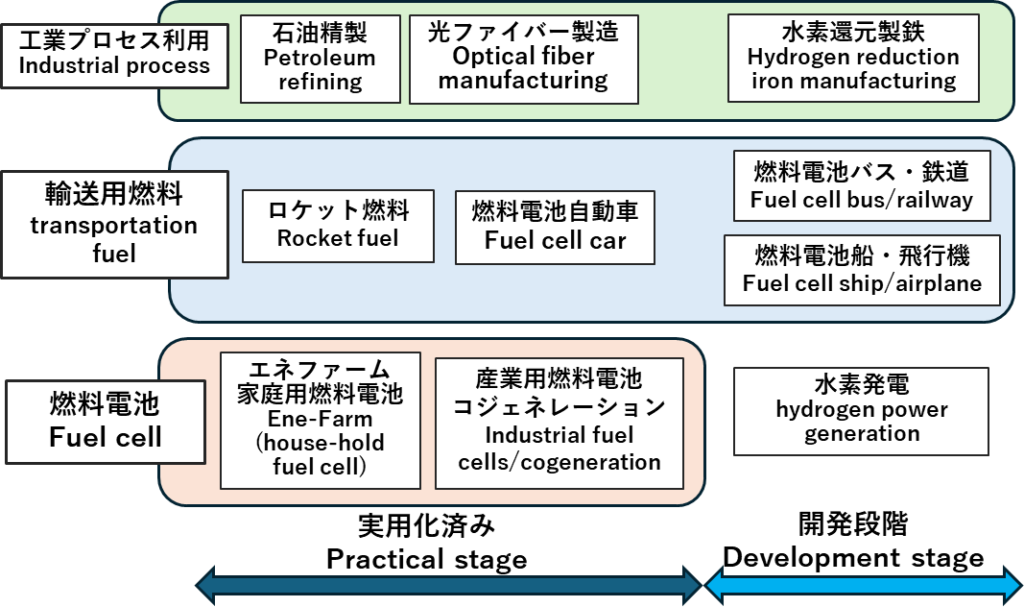
図-2 水素の利用
(1)燃料電池
燃料電池の代表的なものは家庭用燃料電池であるエネファームです。当初産業用のコジェネレーション施設として使用されていたものを家庭用に応用され、実用化されています。2023年末までに50万基が販売されており、その原理やエネルギー使用特性については以下を参照ください。
エネファームの原理や普及状況:
エネファーム(1)-電気と湯を同時につくる創エネシステム
エネファームの導入効果(電気代、CO2削減量等):
エネファーム(2)-導入効果の定量分析~エコキュートとどちらが有利?
さらに既に実用化されている燃料電池自動車も日本が先駆けて開発、販売されました。EVとの競合もあり、EVよりも走行距離が長い特徴を生かして、バス、トラック用への期待が高まっています。今後の実用化対象として、船舶、鉄道、飛行機などへの拡大を目指しています。
(2)水素発電
燃料としての利用ではロケット燃料として既に使われており、水素発電についても期待されています。燃料電池とは異なり水素の熱エネルギーを利用して化石燃料に混ぜて発電する混焼発電、さらに専焼発電までを目指しています。
現状では天然ガスの火力発電においてグリーン水素を混焼させることで発電時のCO2排出量を削減する開発が進められています。水素のみで発電する専焼発電については世界的に事例が少なく、今後さらに検討が必要なようです。
水素は天然ガスなどの既存の燃料に比ベると、発熱量が低い、燃焼速度が速い、火炎温度が高いなどの燃焼特性を持つため、燃焼部材への影響を含め、耐熱性、NOx 低減技術など水素ガスの燃焼に向けてガスタービンの各種構造の最適化が必要となります。
イタリア最大の電力会社ENEL とGE とが水素専焼ガスタービン(16MW級)を開発し、2009 年より水素専焼発電の運転を開始しています。川崎重工業は水素混焼用ガスタービンとして水素濃度が体積当たり30%までの混焼において、天然ガス焚き並みの低NOxである燃焼技術の開発に成功しています6)。また、三菱重工業は水素専焼技術の開発を2025年までに完成させ、2030年には商用化することを公表しています7)。
(3)水素還元製鉄
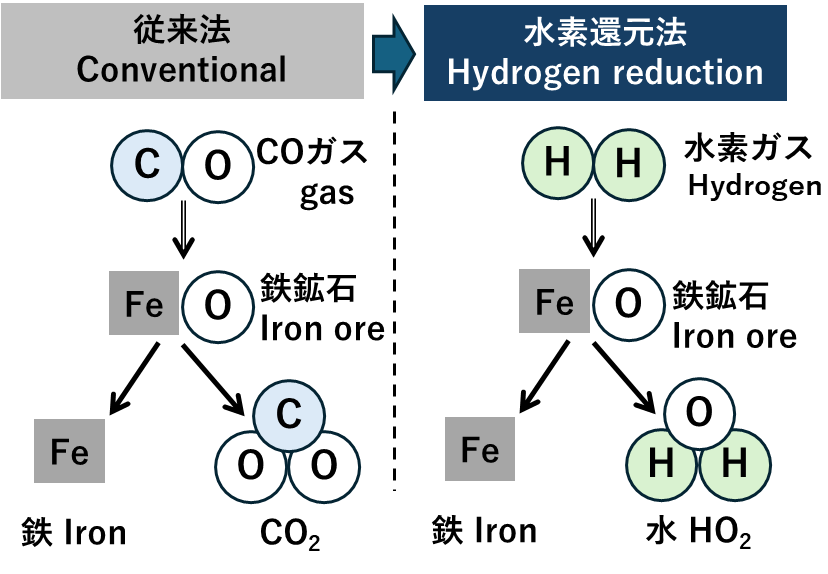
水素還元製鉄とは高炉で還元剤として使用しているコークスの代わりに水素を使用する製鉄方法を言います。鉄鉱石は酸化鉄(FeO)として酸素を含むものですが、これに炭素(コークス)を加えることで酸素を除去(還元)して鉄のみを取り出すのが製鉄の技術です。コークスは化石燃料であるため、これを水素に変えることでCO2削減を達成します(図-3)。
製鉄に水素を用いて行う方法の事例を表-3に示します8)。水素を直接高炉に吹き込む方法(コークスとの混焼)と水素をメタン等に改質して吹き込む方法があります。さらに、コークスを用いずに水素を加熱して直接吹込みDRIを生成し、それを電炉で製鉄する方法もあります。
表-3 水素還元製鉄の手法と技術的な特徴
| 高 炉 法 | 直接還元法 | ||
|---|---|---|---|
| COURSE50技術 | カーボンリサイクル技術 | 水素直接還元技術 | |
| 構 成 |  |  |  |
| 技術の 特徴 | ・水素直接吹込み ・水素予熱 | ・水素間接吹込み ・純酸素吹込み | ・水素直接吹込み |
出所)資源エネルギー庁:スペシャルコンテンツ、水素を活用した製鉄技術、今どこまで進んでる?、2021年10月21日
日本では日本製鉄が既に2008年より高炉水素還元の実証試験(試験炉12m3)を行っており、2026年度から実機を用いた実証試験(4500m3)を行う予定です9)。なお、この実証試験での水素は製鉄所で発生する水素を加えるもので外部からの水素を使用するものではありません。
日本製鉄等ではさらに外部水素を大型高炉に受け入れる実証試験も始めており、2050年までにCO2排出量を50%削減する技術を確立するとしています10)(NEDOのグリーンイベーション基金事業で、日本製鉄株式会社、JFEスチール株式会社、株式会社神戸製鋼所、一般財団法人金属系材料研究開発センターの4社が参加)。


<スポンサーサイト>
水素の改質による他のエネルギー生成
水素は前述の通り、エネルギーの特徴としてエネルギー密度が低く不安定であり、輸送などにおいても取り扱いにくい面があります。そのため、水素を他の物質に改質して燃料や原料として使用する方法も検討されています。
以下では水素を改質して生成される合成メタン、合成液体燃料、アンモニアについて説明します。
(1)合成メタン(メタネーション)
20世紀初頭に、CO2と水素から合成メタンを製造する方法をフランスのサバティエ(Paul Sabatier)が開発しています(サバティエ法)。工場や発電所から排出されるCO2を原料とすることで脱炭素化の手段として利用することができます。
サバティエ法は触媒を用いて熱化学的にメタンを製造する技術です11)。コラム内にその熱化学反応式を示します。ΔHはエンタルピーの変化を示しており、左辺と右辺のエンタルピの差がマイナス165kJ/molであることを意味します。ΔHが正の場合は吸熱反応、負の場合は発熱反応です。
| <二酸化炭素と水素からメタンを生成する反応> CO2(g) + 4H2(g) ⇔ CH4(g) + 2H2O(g) ΔH = −165 kJ/mol ※反応式中の(g)は気体、(l)は液体を意味します。 ※ΔHは反応前後のエンタルピーの差を指します(左辺-右辺) ΔHが正の場合は吸熱反応、負の場合は発熱反応です。 ※生成物が気体の水の場合は、ΔHは真発熱量(低位発熱量)です。 |
この反応は発熱反応であり、反応の進行は低温高圧が有利です。触媒としては、Ni系やRu系が用いられることが多いです。CO2からのメタン製造技術としては、この方法の他に、電気化学、光還元、生物学的手法等について研究・開発が行われています。
本方法の課題は、発熱反応に伴う高温による触媒の失活と生成ガスの不純物による活性の問題、金属の化学的劣化の加速などがあり、日本では効率の向上と低価格化を目指して研究が進められています。
参考にメタンの燃焼による熱化学反応式をコラムに示します。1molのメタンが燃焼すると803kJの熱(真発熱量)を生成します。これは表-1に示したメタンの発熱量35.9MJ/m3(=803/22.4)に一致しています(気体1molは22.4Lです)。
| <メタンの燃焼における発熱量> CH4(g)+2O2(g)→CO2(g)+2H2O(g) ΔH = −803kJ/mol(=35.9kJ/L) ※反応式中の(g)は気体、(l)は液体を意味します。 ※ΔHは反応前後のエンタルピーの差を指します(左辺-右辺) ΔHが正の場合は吸熱反応、負の場合は発熱反応です。 ※生成物が気体の水の場合は、ΔHは真発熱量(低位発熱量)です。 |
ドイツではAudi e-gasプロジェクトにおいて、バイオガスから分離したCO2を利用してメタンを合成し、既存のパイプライン網を経由してCNG(圧縮天然ガス)自動車向けステーションへ供給している事例があります(2013年運転開始、メタンの製造能力:300Nm3/h)。
またフランスではJupiter1000プロジェクトにおいて、再エネ電力1,000kWを用いて水素を製造し、その水素と工業地帯などで発生するCO2を用いてメタネーションを行っています。水電解はアルカリ電解型と固体高分子型の2つを併用し、パイプラインにも注入しています(2018年運転開始、メタンの製造能力25Nm3/h)。
(2)合成液体燃料
メタネーションと同様にCO2と水素から液体燃料に合成できます。化石燃料であるガソリン、軽油を代替して脱炭素化していくものです。日本の自動車工業会ではこの合成液体燃料を使用して脱炭素化を目指しています(本サイトの「乗用車(5)-脱炭素化の道筋」を参照ください)。
合成燃料は以前からも化石燃料を改質して製造されており、その技術を応用して合成燃料を製造します。グリーン水素とCO2から生成する合成燃料をe-fuelと称し、理論上は気体、液体、固体の燃料を含みますが、一般的には液体の燃料を指すことが多いようです。
合成液体燃料の製造プロセスを図-4に示します。水素は再エネによる水電解法により生成し、CO2は工場からの排出や空気中から回収し、それらを反応させます。次にCO2をCOに転換して合成ガスを生成し(逆シフト反応)、次にCOとH2を反応(FT合成)させて合成粗油を製造します。さらにそれを精製することでガソリンや航空燃料などを製品化します12)。
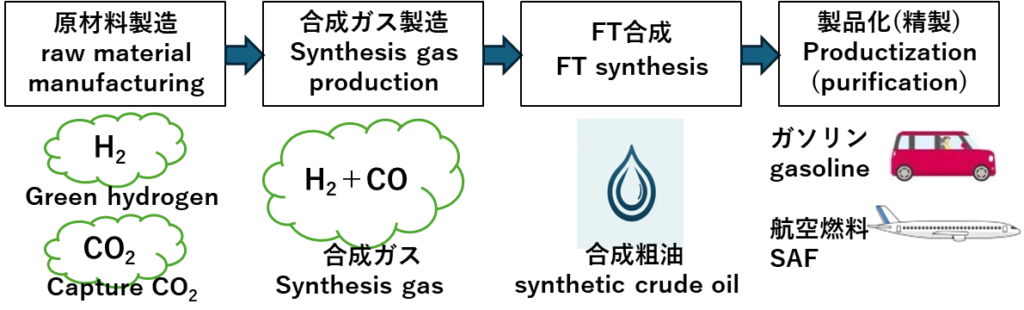
図-4 合成液体燃料の製造プロセス
FT合成は触媒(Co、Feなど)を用いて合成ガスから合成燃料に転換する技術です。FT合成では生成する炭化水素(Cの数が異なるアルカンやアルコール)が幅広く得られるため、目的の液体燃料(炭素数5~19程度)の留分収率を向上させるために温度の調整と触媒を選択します。
逆シフト反応、FT合成の熱化学反応式をコラムに示します。逆シフト反応は高温、高圧下で反応し、41kJ/molの発熱量です。FT合成は温度と触媒により炭素数の異なる炭化水素が発生します。
| <CO2を一酸化炭素(CO)に還元(逆シフト反応)> CO2(g)+H2(g)→CO(g)+H2O(g) ΔH = −41 kJ/mol (高温、高圧) <COを炭化水素に変換(FT合成反応)> nCO+(2n+1)H2→CnH2n+2+nH2O (アルカンの反応) n=5~12のアルカンは常温では液体でガソリンに多く含まれており、n=10~16は灯油に多く含まれています。ここではCOと水素から液体燃料を生成する例として、メタノールの化学反応式を示すと以下の通りです。 CO(g)+2H2(g)→CH3OH(l) ΔH = −128 kJ/mol ※反応式中の(g)は気体、(l)は液体を意味します。 ※ΔHは反応前後のエンタルピーの差を指します(左辺-右辺) ΔHが正の場合は吸熱反応、負の場合は発熱反応です。 ※生成物が気体の水の場合は、ΔHは真発熱量(低位発熱量)です。 |
また、合成液体燃料の燃焼による発熱量について、メタノールとエタノールの例をコラムに示します。メタノールの1mol当りの真発熱量(低位発熱量)は639kJ/mol、エタノールのそれは1,236 kJ/molです。
| <メタノールの燃焼による発熱量> 2CH3OH(l)+3O2(g)→2CO2(g)+4H2O(g) ΔH = −1,278 kJ (メタノール1molに対して639kJ/mol) <エタノールの燃焼による発熱量> C2H5OH(l)+3O2(g)→2CO2(g)+3H2O(g) ΔH = −1,236 kJ/mol ※反応式中の(g)は気体、(l)は液体を意味します。 ※ΔHは反応前後のエンタルピーの差を指します(左辺-右辺) ΔHが正の場合は吸熱反応、負の場合は発熱反応です。 ※生成物が気体の水の場合は、ΔHは真発熱量(低位発熱量)です。 |
(3)アンモニア
アンモニアは常温常圧では無色透明の気体であり、強い刺激臭があって、毒性があるために「劇物」に指定されています。アンモニアの分子式はNH3で、水素と窒素で構成されています。
空気中にある窒素と水素を用いて容易に生成でき、比較的低い温度で液体にできるため、輸送しやすい利点を有しています。そのため、水素のキャリアとして近年注目されています。また、火力発電での化石燃料と混焼することでCO2の排出削減を図ることも検討されています13)。
通常、アンモニアはハーバーボッシュ法により、水素と窒素を鉄触媒存在下で10~25 MPa、570~820℃で反応させて合成されます1)。ハーバーボッシュ法とアンモニアの燃焼における熱化学反応式はコラムの通りです。
| <ハーバーボッシュ法によるアンモニアの生成> N2(g) + 3H2(g) → 2NH3(g) ΔH=-92kJ/mol <アンモニアの燃焼による発熱量> 4NH3(g)+3O2(g) → 4N2(g)+6H2O(g) ΔH=-1,268kJ/mol (アンモニア1molに対して317kJ/mol) ※反応式中の(g)は気体、(l)は液体を意味します。 ※ΔHは反応前後のエンタルピーの差を指します(左辺-右辺) ΔHが正の場合は吸熱反応、負の場合は発熱反応です。 ※生成物が気体の水の場合は、ΔHは真発熱量(低位発熱量)です。 |
これはアンモニア1mol当り317kJ/mol(=1,268/4)の発熱があることを意味しています。アンモニアは燃焼させることでエネルギーとしても利用できますが、燃焼により窒素酸化物(NOx)が発生することが課題です。
(4)水素改質物のエネルギー特性比較
これらの水素改質物質についてそのエネルギー特性を比較したものを表-4に示します。燃焼熱はこれまでの熱化学反応式により計算された発熱量を示しています。合成メタンや合成液体燃料は水素の発熱量(286kJ/mol)よりも大きく、アンモニアはやや大きいというレベルです。
表-4 水素の改質物のエネルギー特性
| 項 目 | アンモニア | 合成メタン | 合成液体燃料 |
|---|---|---|---|
| 燃焼熱 (真発熱量) | 317kJ/mol | 803kJ/mol | メタノール 639kJ/mol エタノール 1,236kJ/mol |
| 輸送効率 | 約1/1,300 (-33℃、常圧で液体) | 約1/600 (-162℃常圧で液体) | 常温常圧で液体 |
| 毒性 | 毒性、腐食性あり | 毒性なし | 毒性なし |
| エネルギーロス | 脱水素時(20%以下) | CO2合成時(32%程度) | CO2合成時 |
| 直接利用の可否 | NH3として直接利用可能 | 都市ガスとして直接利用可能 | 燃料として直接利用可能 |
| 既存インフラ の活用可否 | LPGのインフラ技術が利用可能 | 既存LNGインフラが利用可能 | 既存石油インフラが利用可能 |
| 実用化への課題 | 直接利用先拡大への技術開発、 脱水素設備の技術開発が必要 | 高効率や大型化への技術開発、 再エネ由来水素の供給が必要 | 高効率化や低コストへの研究開発 |
注)燃焼熱は参考文献に記載無いので追加で記載。水素の燃焼熱は286kJ/molである。
アンモニアは前述のように毒性と腐食性という面で難があり、一般的な家庭での利用ではなく工業や発電利用などに適していると言えそうです。メタンやアルコールは毒性もなく、これまでも都市ガスや燃料として使用されてきているため、比較的家庭でも使用しやすいものと思われます。
また、アンモニアと合成メタンは常温、常圧では気体であり、輸送面で難があります。そのため液体で輸送する場合は、アンモニアは常圧で-33℃、合成メタンは-162℃以下に温度を低下させる必要があります。合成液体燃料は常温で液体のため輸送や貯蔵の面で最も優位、次いでアンモニアが優位となります。
ただし、合成メタンは既存インフラの活用面では既存LNGインフラが活用でき、さらに都市ガスとして利用できるため、都市ガスのパイプラインを使用できるという輸送面での最も優れた特徴を有しています。
それぞれの課題として、アンモニアの直接利用先の拡大対策、合成メタンと合成液体燃料は低コストな再エネ由来水素の確保が重要と言えそうです。
<スポンサーサイト>
水素の輸送、貯蔵方法
水素のエネルギー密度は低く(天然ガスの1/3)、これをどのように輸送・貯蔵するかが課題です。以下ではまず水素の体積を減少させる減容方法について整理し、次に輸送と貯蔵のための技術について整理していきます。
(1)水素の減容方法
水素の輸送効率を向上させるために体積を減容化する以下の方法が開発されています。
・高圧ガス化
・液化
・有機ハイドライド
高圧ガス化とは高圧をかけることで気体を圧縮するものです。圧力の程度によって圧縮度が変わるため、輸送効率と圧縮によるコスト上昇のバランスを検討する必要があります。また、液化するためには-253℃までの冷却が必要です。
さらに、化学反応により水素を改質する有機ハイドライド法もあります。その代表的な手法がトルエンと水素を反応させメチルシクロヘキサン(MCH)として減容化する方法です。これらの方法の水素の圧縮程度を図-5に示します1)。
同図に示す通り、液化水素の質量密度が最も高く(圧縮率が高い)、次いでメチルシクロヘキサン、70MPaでの圧縮水素の順になっています。これらの手法の評価は、その輸送、貯蔵効率と圧縮コストとの総合的な評価が必要です。
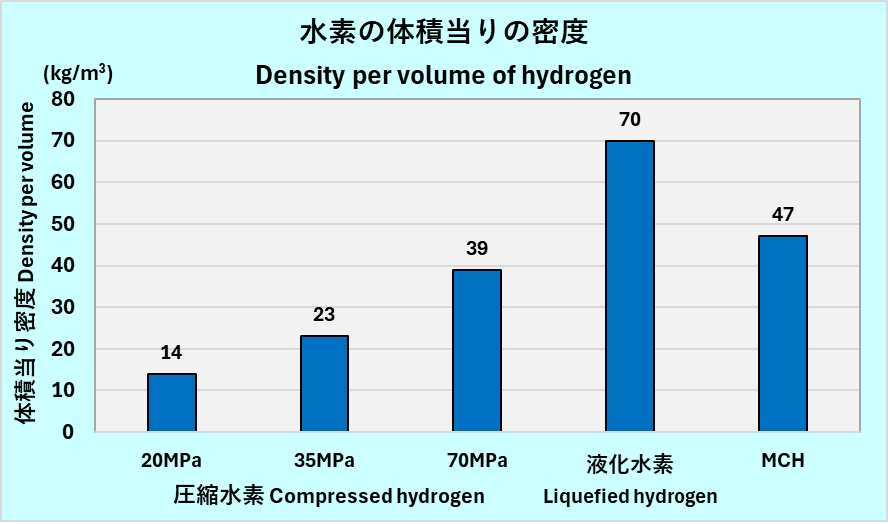
出所)新エネルギー・産業技術総合開発機構:水素エネルギー白書、2015年2月
図-5 水素の体積当り密度
(2)水素の輸送
水素を輸送する方法は車両(船舶含む)による方法とパイプラインによる方法があります。車両については減容化の方法によって輸送に適した構造が必要になります。高圧ガスの場合は高圧への対応、液化水素を輸送する場合は低温への対応が必要です。
天然ガスの輸送などで既に技術開発は行われています。高圧ガストレーラーは一般的には20MPaに加圧してシリンダーに充填しそれを束ねて運搬します。輸送効率を向上するため、近年は45MPaの水素を輸送できる車両についても開発されています。

液化水素の輸送も可搬式超低温容器(145~350L)、コンテナ(2~46m3)、液化ガスローリー(23m3)が使用されています。液化に要するエネルギーは、従来は水素が有する熱量の1/3程度の11.9kWh/kgを要していましたが、現在6 kWh/kg程度への低減を目指した研究開発が行われています。
MCHの輸送のためにケミカルローリーやなどが既に実用化されています。また、液化水素の輸送船なども開発されています。MCHの場合は水素脱離(MCHから水素にもどす)際にエネルギーを要する(吸熱反応)ため、その効率的な手法の開発が進められています。
一方、パイプラインについてはコンビナート内での狭い区域内での布設が行われているだけで、広域的な輸送は行われていません。パイプラインの整備には初期コストがかかり、維持管理に係る安全性確保が難しいとされています。
水素は、表-1に示したように金属をもろく、割れやすくする特性があり、亀裂や破壊発生時の挙動などの解析を行っている段階にあります。ただし、EU諸国では800km以上に及ぶパイプラインを整備して供給している事例があり、技術的には不可能ではないようです。
ただし、これらのパイプラインによる輸送は工業用にとどまっており、一般家庭への輸送には多くの解決すべき課題が残されていると言ってよいでしょう。冒頭に示した水素をパイプによって一般家庭に供給することができれば、エネファームが低価格化し普及が進むと予想したのは現状では難しいと思われます。
(3)水素の貯蔵
高圧水素、液化水素、MCHの貯蔵についてはそれぞれの特徴に合わせた貯蔵容器を整備して貯蔵されます。ここでは、水素を減容化せずに可逆的に水素と反応して貯蔵することができる水素吸蔵合金について説明します。
水素吸蔵合金の体積当りの水素貯蔵量は90kg/m3と大きく、液化水素のそれ(70kg/m3)よりも減容化率は優れています。しかし、合金自体の重量が重いので、重量当りの吸蔵量が小さく、現状では4%程度となっています。
水素吸蔵合金の種類と水素吸蔵量を表-5に示します。Mg系合金が4%程度の吸蔵率となっています。容器の圧力は30℃において0.2MPa程度であり貯蔵圧力が低いため安価な金属で対応が可能です。ただし、コストは現状で5,000~10,000円/kgと効果であり、より安価な材料の研究開発が行われています1)。
表-5 水素吸蔵合金の種類と吸蔵量
| 種類 | 主な系 | 水素吸蔵量 |
|---|---|---|
| AB5型合金 | LaNi | 1 重量% |
| AB2型合金 | TiCr1.8、ZrMn2 など | ~2 重量% |
| AB型合金 | TiFe など | ~2 重量% |
| BCC構造合 | Ti-Mn-V 系、Ti-Cr-V 系、V-Ti-Cr 系など | ~3重量% |
| Mg系合金(A2B型) | Mg2Ni、Mg2Cu など | ~4 重量% |
<スポンサーサイト>
水素利用の課題
ここでは、水素を利用する社会の構築に向けて、その課題を整理します。課題の掘り下げについては次回以降で考察することとし、本報告では課題を列挙するのみとします。
・水素の製造コスト: 現在、水素の製造コストは比較的高く、競争力のある価格で提供するためには技術革新やスケールメリットの確保が必要です。スケールメリットを出すためには水素の需要の拡大が重要です。
・水素の輸送:輸送のための車両(船舶含む)は実用化されていますが、そのコストの低減が必要です。パイプラインによる輸送は工業団地等の狭い区域のみで行われており、広域のインフラ整備はコストが課題です。
・水素の貯蔵: 水素の減容化により効率的な貯蔵を行うことが必要ですが、高い圧力や低温での貯蔵が必要であり、そのための設備や技術の整備が課題となります。水素キャリアの活用も含めて効率的な貯蔵方法の確立が必要です。
・安全性への懸念: 水素は高い爆発性を持つため、安全性への懸念があります。水素の安全性を確保するための技術開発や規制の整備が必要です。
・インフラの整備: 水素社会を実現するためには、水素の製造、貯蔵、輸送、供給などを支えるインフラの整備が必要です。これには膨大な投資が必要となります。水素キャリアとしての合成メタンによる都市ガスのインフラや、合成液体燃料によるガソリンスタンドなどを活用することも含め、効率的なインフラ整備が求められます。
・社会の受容性: 水素社会を実現するためには、社会全体がその重要性を理解し、受容する必要があります。水素社会への移行には、政策的な支援や啓発活動が必要とされます。
日本政府は水素社会を実現するために「水素基本戦略」を2023年に改訂しました。そこでは、上記の水素社会に移行する際の課題を見据えた対策が展開されていると考えられます。
次回は、水素の製造、輸送・貯蔵、利用の面でのコスト、技術開発の現状をまとめ、日本政府が展開する水素基本戦略について整理するとともに、その実現性などについても考察していきます。
<スポンサーサイト>
付録 化学反応式における熱収支の計算
本報告では水素に関連する化学反応の熱収支に着目しています。これは、燃焼による発熱量がどの程度なのかの情報を把握するとともに、水素を含む物質の生成に必要なエネルギーに関する情報も得ることができるためです。
反応に伴う熱収支は反応に伴うエンタルピーの変化の計算により分析します。一例として、以下のメタンの燃焼反応におけるエンタルピーの変化を説明します。ΔHはエンタルピーの変化を示す記号です。ΔHがマイナスなのでエンタルピーは反応後に減少し、これは発熱反応であることが分かります。
CH4+2O2→CO2+2H2O ΔH = −803 kJ/mol (=35.9kJ/L)
それぞれの物質には標準生成エンタルピーという物質が持つエネルギー量が定義されています。上記の場合は以下の通りです。分子式後の(g)は気体、(l)は液体を示します。
CH4(g):-75kJ/mol
O2(g):0 kJ/mol
CO2(g):-394 kJ/mol
H2O(g):-242 kJ/mol
反応物と生成物の合計エンタルピーは以下で計算されます。
CH4(g)(-75)+2O2(g)(2・0)=-75 kJ/mol
CO2(g)(-394)+2H2O(g){ 2・(-242) }=-878 kJ/mol
反応前後のエンタルピーの変化は以下です。
エンタルピーの変化=左辺-右辺=-878-(-75)=-803 kJ/mol
本報告ではそれぞれの物質の標準生成エンタルピーは米国国立標準技術研究所のサイトから、小数点以下を四捨五入した値を用いています。代表的な物質の標準生成エンタルピーを下表に示します。標準生成エンタルピーは常温での状態(気体、液体)の値を示していますが、水は気体と液体の両方を示しています。
付表-1 物質の標準生成エンタルピー
| 化学式 | 物質名 | 標準生成エンタルピー (kJ/mol) | 状態 |
|---|---|---|---|
| C2H5OH(l) | エタノール | -278 | 液体 |
| C2H6(g) | エタン | -84 | 気体 |
| CH3OH(l) | メタノール | -239 | 液体 |
| CH4(g) | メタン | -75 | 気体 |
| CO(g) | 一酸化炭素 | -111 | 気体 |
| CO2(g) | 二酸化炭素 | -394 | 気体 |
| H2(g) | 水素分子 | 0 | 気体 |
| H2O(g) | 水(気体) | -242 | 気体 |
| H2O(l) | 水(液体) | -286 | 液体 |
| N2(g) | 窒素分子 | 0 | 気体 |
| NH3(g) | アンモニア | -46 | 気体 |
| O2(g) | 酸素分子 | 0 | 気体 |
<参考文献>
1) 新エネルギー・産業技術総合開発機構:水素エネルギー白書、2015年2月
2) 資源エネルギー庁:公式Webサイト、スペシャルコンテンツ、次世代エネルギー「水素」、そもそもどうやってつくる?、2021年10月12日
3) 科学を分かりやすく解説:石炭ガスとは、2024年2月20日閲覧
4) 金子祥三:石炭ガス化技術と水素製造、水素エネルギーシステム、Vo1. 37,No.1、2012
5) 資源エネルギー庁:2022年度、2023年度エネルギー白書(エネルギーに関する年次報告)
6) 川崎重工業:公式Webサイト、ニュースリリース、30MW級ガスタービンに搭載する水素30%混焼DLE燃焼器を販売開始、2022年08月02日
7) 三菱重工業:公式Webサイト、水素ガスタービン30%混焼技術が完成、CO2フリーへの道のり、2018年3月30日
8) 資源エネルギー庁:スペシャルコンテンツ、水素を活用した製鉄技術、今どこまで進んでる?、2021年10月21日
9)日本製鉄:公式Webサイト、ニュースリリース、大型高炉実機を用いた高炉水素還元の実証試験の開始決定、2023年2月9日
10) 新エネルギー・産業技術総合開発機構:ニュースリリース、グリーンイノベーション基金事業、製鉄プロセスでの水素活用プロジェクトに着手、2022年1月7日
11)高木 英行(産総研):メタネーション技術に関する動向、メタネーション推進官民協議会、2021年6月28日
12) エネルギー金属鉱物資源機構:公式Webサイト、カーボンニュートラルで話題の「合成燃料(e-fuel)」とは?、2024年4月8日閲覧
13) 資源エネルギー庁:公式Webサイト、アンモニアが“燃料”になる?!(前編)~身近だけど実は知らないアンモニアの利用先、2021年1月15日
